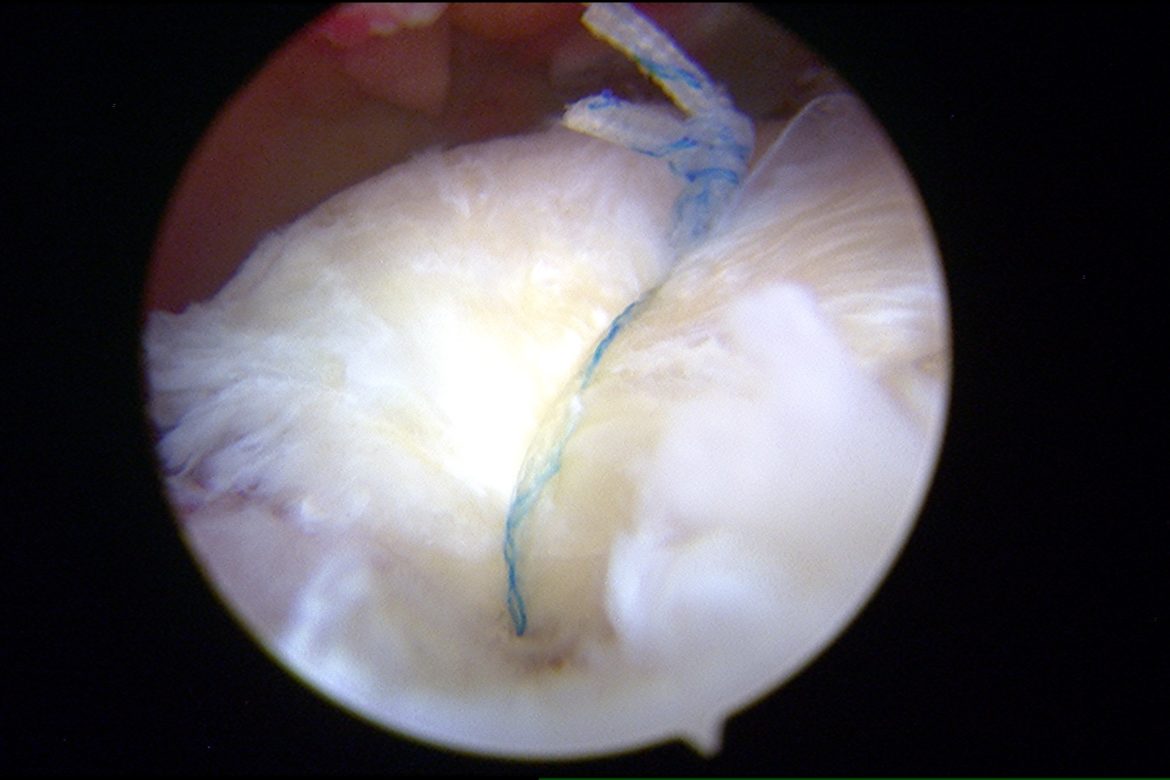
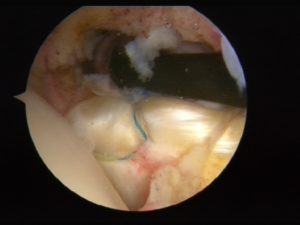
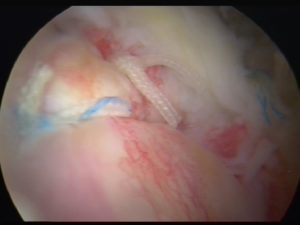
NOVITA’ IN CHIRURGIA PROTESICA DI GINOCCHIO
In questo post verrà descritto l’iter diagnostico-terapeutico al quale il paziente viene sottoposto e verranno spiegati i materiali delle protesi che maggiormente utilizzo e la ragione.
Dott. Gaetano Maci
Negli ultimi anni abbiamo assistito ad un incremento radicale della chirurgia sostitutiva protesica del ginocchio in pazienti sempre più giovani.
Tale fenomeno si spiega da un lato per l’aumento dell’attività sportiva nei giovanissimi con usura più rapida delle cartilagini articolari, dall’altro per la realizzazione da parte di aziende italiane e straniere di impianti sempre meno invasivi, di rivestimento, anallergici e che permettono di integrarsi sempre più con l’anatomia del paziente, garantendo una buona funzionalità articolare ed una durata maggiore nel tempo.
Una buona protesi dovrebbe quindi avere caratteristiche che ne garantiscano la longevità e la perfetta integrazione anatomica.
 |
 |

|
|
| Si ricorre ad un intervento di sostituzione protesica parziale o totale quando uno, due o tutti e tre i comparti della articolazione sono danneggiati per una qualsiasi patologia (degenerativa, infiammatoria, post-traumatica) ed un trattamento conservativo (medico, fisioterapico, ortesico) non è più in grado di controllare il dolore e la disfunzione è necessario ricorrere ad un trattamento chirurgico.
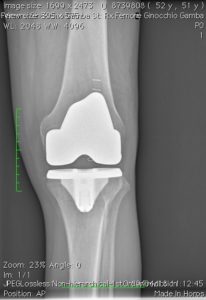
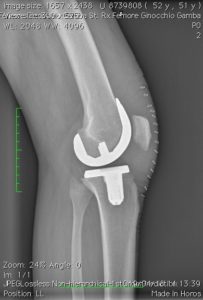
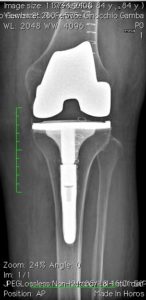
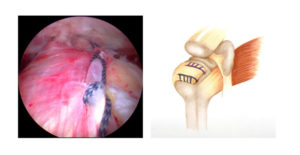
Con la protesizzazione del ginocchio, le parti usurate o danneggiate dell’articolazione saranno sostituite o rivestite con elementi artificiali. Quali materiali utilizzo e perchè?
È ben noto che qualsiasi materiale metallico, tranne quelli nobili, all’interno di un organismo biologico è sottoposto al processo di corrosione e quindi al rilascio di ioni metallici. Molti metalli pesanti possono scatenare nell’organismo una reazione di ipersensibilizzazione. Metalli noti come sensibilizzatori sono berillio, nichel, cobalto, cromo e, occasionalmente tantalio, titanio e vanadio. Il nichel è il più comune allergene tra i metalli, seguito dal cobalto e dal cromo. Gli ioni metallici, pur non essendo loro stessi degli allergeni, possono attivare il sistema immunitario formando complessi con le proteine già presenti nell’organismo. Questi complessi proteici sono potenziali allergeni responsabili di innescare risposte di ipersensibilità ritardata, cellulomediata. Il fenomeno delle allergie fra i pazienti portatori di protesi metalliche impiantabili è in continuo aumento come è in aumento anche la sensibilità da parte della comunità ortopedica verso tale problematica. L’esigenza di tipologie di protesi “anallergiche” di conseguenza è in continuo aumento. Per eliminare qualsiasi rischio di reazione allergica, utilizzo protesi con rivestimento Bioloy o in Oxinium. Il rivestimento BIOLOY® è un rivestimento ceramico che ha lo scopo di formare uno strato inerte e isolante che faccia da interfaccia fra il paziente (ovvero i tessuti ed i liquidi) ed il metallo costituente la protesi, impedendo di conseguenza il passaggio di ioni metallici dalla protesi verso il paziente. La funzione principale è infatti quella di creare una barriera fisica tra il substrato metallico e l’ambiente organico circostante impedendo il rilascio degli ioni metallici dal substrato: ciò permette di ridurre notevolmente il rischio di scatenare o sviluppare reazioni allergiche causate dagli elementi metallici di lega del dispositivo (i.e. Ni, Co, Cr). Il rivestimento BIOLOY® permette quindi di:
Il rivestimento BIOLOY®, inoltre, grazie alla sua elevata durezza e resistenza all’abrasione, migliora anche le prestazioni tribologiche delle superfici articolari delle leghe metalliche di cui sono costituite le protesi diminuendo così l’usura del polietilene.
L’ OXINIUM ™ o Zirconio Ossidato è una lega metallica brevettata disponibile per i sistemi di anca e di ginocchio e quasi 1 milione di impianti sono stati venduti a livello globale. La sua combinazione di biocompatibilità, maggiore durezza e resistenza all’abrasione la rende una scelta eccellente per la protesi d’anca e di ginocchio.
La degradazione del polietilene e dei polimeri in generale è quel processo tale per cui si ha un’alterazione della struttura chimica del materiale con una diminuzione del peso molecolare. La degradazione diminuisce le caratteristiche meccaniche del polietilene e, quindi, causa un’usura precoce. La degradazione di un polimero avviene con la rottura di alcuni legami chimici e la creazione di nuovi radicali liberi quando ad esempio il materiale viene esposto ad una quantità di energia superiore a quella dei legami chimici stessi di cui sono costituite le catene molecolari del polimero. Tale processo in presenza di ossigeno viene chiamato degenerazione ossidativa o più semplicemente ossidazione. L’ossidazione determina la degradazione della struttura molecolare del polietilene e quindi nel tempo ne causa un progressivo decadimento delle proprietà meccaniche e tribologiche. L’aggiunta di minime concentrazioni di vitamina E nel polietilene elimina il problema dell’ossidazione e di conseguenza aumenta la sua longevità.
Se non sono presenti altre patologie la protesi permetterà un ritmo di vita normale ma dovranno essere limitate le attività che possono sovraccaricare il ginocchio operato. Un ginocchio rivestito o sostituito da una protesi tuttavia non può essere come un’articolazione normale, anche se ben funzionante, soprattutto se è stato effettuato un impianto totale. Soprattutto nei pazienti giovani, l’’intervento di artroprotesi può pertanto richiedere un secondo intervento (correlato a fenomeni di usura della protesi e/o altre patologie dell’osso circostante) in una percentuale di circa il 5 – 10% nei primi quindici anni dall’impianto.
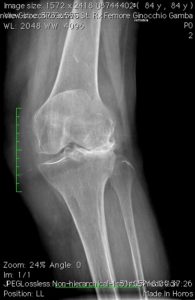
Indicazioni Il trattamento chirurgico di rivestimento o sostitutivo è tradizionalmente riservato alle persone oltre i 60 anni anche se in casi selezionati, in genere dopo traumatismo maggiore o microtraumatismo iterativo in sportivi high demand (baby boomer generation), è sempre più frequente eseguire questo tipo d’intervento a persone più giovani: soprattutto nell’artrosi monocompartimentale, per una scelta di qualità di vita del paziente, l’età di maggiore incidenza per la protesizzazione di rivestimento si è spostata di 10 anni, interessando precipuamente la fascia tra i 45 e 55 anni.
Le principali indicazioni all’intervento sono determinate da: 1. Dolore (se presente tutti i giorni) 2. Deformità 3. Disabilità (se limita il lavoro e/o le comuni attività quotidiane e ricreative) Condizioni che aumentano il rischio operatorio sono:
Condizioni che al momento non permettono l’intervento:
Prognosi La completa guarigione necessita di alcuni mesi ed è importante effettuare regolarmente gli esercizi imparati durante la riabilitazione e continuare l’attività di rinforzo muscolare. Il ritorno alle comuni attività avviene di norma dopo due-sei mesi dall’intervento, a seconda che si sia effettuato l’impianto monocompartimentale (45gg) o totale (ca 2.5m) con tecnica MIS (mini-invasiva) o less invasive/tradizionale (5cm).
Iter diagnostico L’iter inizia con una visita ambulatoriale specialistica ortopedica, durante la quale l’ortopedico, in presenza di sintomatologia dolorosa del paziente e se il paziente non sia già in possesso di radiogrammi standard del ginocchio recenti (che di norma vengono richiesti all’atto della prenotazione della visita ambulatoriale), procederà con esami atti a stabilire la presenza di artrosi nonché la qualità minerale ossea:
Qualora il quadro clinico e radiologico siano già diagnostici per artrosi del ginocchio, lo specialista ortopedico provvederà ad inserire il paziente in lista d’attesa per l’intervento e a sottoporre al paziente il modulo di consenso specifico all’intervento di artroprotesi di ginocchio.
In casi dubbi possono essere richiesti ulteriori esami:
Iter pre-operatorio pre-ricovero Comprende:
Scelta della protesi: –monocompartimentali mediale, laterale, femoro-rotulea -protesi totali che possono a seconda del bone stock del paziente essere CEMENTATE O NON CEMENTATE. La scelta del tipo di protesi (mono, totale) nell’ “earlier intervention” si basa in prima analisi sul quadro Rx (TeleRx in ortostatismo). Uteriori elementi nella indicazione della tipologia protesica sono costituiti da: età (<50 -50-75- >75°), richieste funzionali (high, medium, low demand), morfotipo (magro, normale, obeso) del paziente.
Preparazione all’intervento Comprende:
Iter terapeutico-assistenziale post-operatorio Comprende:
DECORSO POST OPERATORIO
|