|
PROTESI DI GINOCCHIO
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
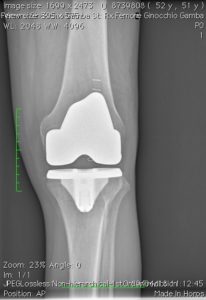 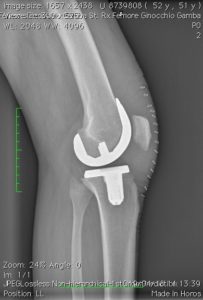 
Quando uno, due o tutti e tre i comparti della articolazione sono danneggiati per una qualsiasi patologia (degenerativa, infiammatoria, post-traumatica) (vedi Tabella 1) ed un trattamento conservativo (medico, fisioterapico, ortesico) non è più in grado di controllare il dolore e la disfunzione è necessario ricorrere ad un trattamento chirurgico. Tabella 1
Con la protesizzazione del ginocchio, le parti usurate o danneggiate dell’articolazione saranno sostituite o rivestite con elementi artificiali: una componente metallica (cromo-cobalto o oxinium) o di ceramica sul femore, una di metallo (titanio) sulla tibia, con interposto un inserto di polietilene fisso o mobile, crosslinkato o e-vitaminizzato, nell’impianto totale o monocompartimentale, mentre la rotula sarà sostituita a discrezione dell’operatore, effettuando al bisogno artrocheiloplastica con condroplastica sec. Pridie e lateral release; nell’artrosi femoro-rotulea il comparto non coperto da cartilagine sarà rivestito con una componente metallica femorale (trocleare in cromo-cobalto o oxinium) ed una componente polietilenica a livello della superficie inferiore rotulea. Se non sono presenti altre patologie la protesi permetterà un ritmo di vita normale ma dovranno essere limitate le attività che possono sovraccaricare il ginocchio operato. Un ginocchio rivestito o sostituito da una protesi tuttavia non può essere come un’articolazione normale, anche se ben funzionante, soprattutto se è stato effettuato un impianto totale. Soprattutto nei pazienti giovani, l’’intervento di artroprotesi può pertanto richiedere un secondo intervento (correlato a fenomeni di usura della protesi e/o altre patologie dell’osso circostante) in una percentuale di circa il 5 – 10% nei primi quindici anni dall’impianto.
Indicazioni Il trattamento chirurgico di rivestimento o sostitutivo è tradizionalmente riservato alle persone oltre i 60 anni anche se in casi selezionati, in genere dopo traumatismo maggiore o microtraumatismo iterativo in sportivi high demand (baby boomer generation), è sempre più frequente eseguire questo tipo d’intervento a persone più giovani: soprattutto nell’artrosi monocompartimentale, per una scelta di qualità di vita del paziente, l’età di maggiore incidenza per la protesizzazione di rivestimento si è spostata di 10 anni, interessando precipuamente la fascia tra i 45 e 55 anni.
Le principali indicazioni all’intervento sono determinate da: 1. Dolore (se presente tutti i giorni) 2. Deformità 3. Disabilità (se limita il lavoro e/o le comuni attività quotidiane e ricreative) Condizioni che aumentano il rischio operatorio sono:
Condizioni che al momento non permettono l’intervento:
Prognosi La completa guarigione necessita di alcuni mesi ed è importante effettuare regolarmente gli esercizi imparati durante la riabilitazione e continuare l’attività di rinforzo muscolare. Il ritorno alle comuni attività avviene di norma dopo due-sei mesi dall’intervento, a seconda che si sia effettuato l’impianto monocompartimentale (45gg) o totale (ca 2.5m) con tecnica MIS (mini-invasiva) o less invasive/tradizionale (5m).
Iter diagnostico L’iter inizia con una visita ambulatoriale specialistica ortopedica, durante la quale l’ortopedico, in presenza di sintomatologia dolorosa del paziente e se il paziente non sia già in possesso di radiogrammi standard del ginocchio recenti (che di norma vengono richiesti all’atto della prenotazione della visita ambulatoriale), procederà con esami atti a stabilire la presenza di artrosi nonché la qualità minerale ossea:
Qualora il quadro clinico e radiologico siano già diagnostici per artrosi del ginocchio, lo specialista ortopedico provvederà ad inserire il paziente in lista d’attesa per l’intervento (vedi P02 “Procedura di modalità di accesso”) e a sottoporre al paziente il modulo di consenso specifico all’intervento di artroprotesi di ginocchio (vedi P37 “Procedura di acquisizione del consenso informato”). In casi dubbi possono essere richiesti ulteriori esami:
Iter pre-operatorio pre-ricovero Comprende:
1.6 Pianificazione pre-operatoria Comprende:
ü MIS mini-midvastus (nella >parte dei casi) ü MIS mini-subvastus (in pazienti con piano capsulare spesso e robusto) ü “Less invasive-midvastus” (in esiti di osteotomia o UNI o in pazienti obesi)
ü Minisplit capsulare cm parapatellare mediale o laterale di ca 4 cm
–monocompartimentali mediale, laterale, femoro-rotulea -protesi totali che possono a seconda del bone stock del paziente essere CEMENTATE O NON CEMENTATE. La scelta del tipo di protesi (mono, totale) nell’ “earlier intervention” si basa in prima analisi sul quadro Rx (TeleRx in ortostatismo). Uteriori elementi nella indicazione della tipologia protesica sono costituiti da: età (<50 -50-75- >75°), richieste funzionali (high, medium, low demand), morfotipo (magro, normale, obeso) del paziente.
PROTESI MONOCOMPARTIMENTALI CEMENTATE (PROTESI MONOCOMPARTIMENTALE-UNI MEDIALE/LATERALE O PROTESI FEMORO-ROTULEA-PFR)
PROTESI MONOCOMPARTIMENTALI
In questi ultimi anni, si è assistito ad una riscoperta della protesi di ginocchio monocompartimentale. Persino negli U.S.A. si ha una nuova visione della protesizzazione monocompartimentale, grazie agli articoli di Andriacchi, Galante, Keblish (8,23,55), che hanno permesso di riconsiderare il problema, dopo i primi report negativi. Oggi, è ormai dato di fatto che la mono non è metà protesi totale, ma un mondo a sé, con una filosofia conservativa precisa ed accettata. Si parla, sempre più spesso, di mini incisione e invasività, posizionamento guidato con strumentari ricercati, navigazione assistita, da computer, e ricovero “one day surgery “. Nei riguardi della mono, esistevano parecchi pregiudizi, frutto di notizie imprecise ed allarmanti che circolavano tra i chirurghi, legate al fatto che, agli albori della sua vita, ha conosciuto, più di altre metodiche, complicanze ed insuccessi, dovuti alle errate indicazioni ed alle difficoltà tecniche, che hanno aperto la strada alla protesi totale, maggiormente spinta dal mercato, perché ritenuta più semplice da applicare e più sicura. Da un punto di vista strettamente chirurgico, essa rappresenta un presidio, notevolmente, meno invasivo della protesizzazione totale. Infatti, l’apparato legamentoso non è lesionato, così come l’articolazione femoro-rotulea (Corpe, 1990); non necessita di uno strumentario intramidollare, pur consentendo una correzione tridimensionale, senza alterare l’asse meccanico (Dejour, H., 1991) e soprattutto violare il canale midollare con maggior rischio di tromboembolismo. In caso di fallimento, il ricorso alla protesizzazione totale, in virtù della scarsa resezione ossea che ne preserva il bone stock, non presenta eccessivi problemi (Levine, 1996; Jackson,1997) e la sepsi, qualora sfortunatamente insorga, si presenta con quadri più modesti e maggiormente risolvibili. Accanto a questi vantaggi per il chirurgo, ne esistono di pratici anche per il paziente:
– ridotte perdite ematiche, tanto da non dover più ricorrere alla trasfusione di sangue, neppure in caso di protesizzazione bilaterale nella stessa seduta operatoria (per questo, dal 2005, la nostra divisione è un punto di riferimento nazionale per i Testimoni di Geova) – minor rischio di trombosi venosa e sepsi – maggiori indicazioni ad un’anestesia locoregionale – minor lift off del comparto laterale, rispetto alla totale, per la presenza del LCA (1,8) – possibilità di utilizzare solo il polietilene, per la componente tibiale, per il minor stress osseo subcondrale, per l’assenza di lift off che causa concentrazioni di stress tali da dover essere ammortizzate con un metal backing – minori degenze ospedaliere con più veloci e migliori o pressocchè completo recuperi della funzionalità articolare, rispetto alla totale (Chassin e Andriacchi, 1996; Mikosz, 1993; Newman 1998; Robertsson 1999 e 2000, Squire 1999). Questo la pone come indicazione prioritaria nei pazienti affetti dal morbo di Parkinson, dove, spesso, la totale porta ad un peggioramento del quadro neurologico, almeno nella nostra esperienza. Il tutto per un evidente risparmio della spesa sanitaria, vantaggio non ultimo in tema di gestione delle risorse economiche. Occorre, tuttavia, precisare che questi risultati sono ottenibili, solo a fronte di una rigorosa selezione dei pazienti, ai quali è effettivamente possibile garantire una ripresa dell’articolarità tale, da consentire la pratica di una attività sportiva leggera.
IDEALI INDICAZIONI ALL’IMPIANTO PROTESICO DI RIVESTIMENTO UNICOMPARTIMENTALE erano/sono secondo Scott R.D. (1981), Kozinn (1989), Goutallier (1991), Stem S. H. e Insall J. (1993), Voss. e Galante (1995), Grelsamer R.P. (1995): – artrosi monocompartimentale con comparto controlaterale indenne o con minimo interessamento (grado l° o 2° di Ahlback), – femoro-rotulea non sintomatica, arco di movimento maggiore di 90°, – deviazioni assiali non superiori a 15’, – non dolore a riposo, – assenza di lassità anteriore, – età superiore ai 60 anni, – peso inferiore agli 82 chilogrammi, – rigidità in flessione non superiore ai 5’°
Indicazioni, solo apparentemente limitative, ma che selezionano una gran parte dei nostri pazienti, soprattutto quelli di origine mediterranea e di sesso femminile, rubando spazio più alle protesi totali, che alle osteotomie. Un grande aiuto, nella diagnosi e nella guida delle nostre scelte, ci viene dall’artroscopia, che noi utilizziamo, spesso, preventivamente. (Schai 1998). Alla luce della nostra esperienza, analizziamo alcuni degli aspetti più controversi, portandoli in discussione.
– Età: bisogna valutare da caso a caso. Oggi soprattutto sotto i 60 anni è indicato impiantare una mono, soprattutto, negli esiti infelici di un’osteotomia o di una frattura del piatto tibiale o nel giovane sportivo di alto livello che a fine della carriera agonistica si trova di fronte ad una grave condropatia/artrosi della femoro-rotulea (basket/pallavolo) o della femoro-tibiale (calcio, rugby, sci, tennis..) . Mentre non c’è limite sopra: anzi, nella nostra esperienza, più sono anziani e meglio la tollerano.
– Degenerazione femoro-tibiale monocompartimentale: per noi l’indicazione si pone per il grado 3° e 4° di Ahlback. Per i quadri minori, a seconda dell’età, consigliamo: l’artroscopia, e, per aree limitate, l’innesto di cartilagine con o senza associazione alla HTO (Jackson D. W. 1996, Hangondy L. 1997, Zanasi 2008).
– Femoro-rotulea: difficile trovarla completamente indenne o asintomatica, soprattutto nel valgo. Noi abbiamo notato un miglioramento della sintomatologia, dopo la protesi, soprattutto nell’alzarsi dalla sedia e nello scendere le scale, dovuto al riequilibrio dell’asse meccanico del ginocchio. Spesso associamo gesti chirurgici quali: l’asportazione degli osteofiti, condroplastiche, perforazioni, release dell’alare, soprattutto nel valgo, a volte con una artroscopia preventiva.
– Peso: i limiti imposti sono, ovviamente, relativi. Un uomo alto 1,90 m., non può pesare meno di 82 kg. e, se gli altri parametri lo consentono, per noi l’indicazione alla mono rimane, anche perché la protesi è di misura proporzionata. E’ più importante il sovrappeso con la volontà e la tendenza al dimagrimento. Una donna di 85 kg., con modesto varo, alta 1,70 m., che vorrebbe calare di peso ma è limitata, nel movimento, dal dolore, può avvalersi di una monocompartimentale, così come un paziente in calo che chiede un aiuto per migliorare. Sono quelli che rischiano meno di ingrassare dopo l’intervento. Diverso è il discorso per l’eccesso di peso in osteoporosi con varo, soprattutto per quei piatti che prevedono fittoni o lame stabilizzatrici, controindicazione assoluta all’impianto mono.
– Rigidità articolare: dipende dalla causa: corpi mobili, osteofitosi, problemi patello-fernorali possono essere risolti con l’asportazione durante l’intervento od, in alternativa, con un’artroscopia chirurgica preventiva, seguita dal controllo del beneficio raggiunto. In questo modo, possono essere affrontate limitazioni dell’estensione superiori a 10’.
– Lassità legamentosa: escludiamo le lassità antero-posteriori combinate da lesione del L.C.A. e L.C.P.. Una certa insufficienza del legamento crociato anteriore, con un lieve jerk, non impedisce un buon risultato, soprattutto nell’anziano, anche per la ridotta attività fisica ed il ripristino del bilanciamento laterale, dopo l’intervento. Queste indicazioni, secondo noi, ritagliano una popolazione di pazienti ben superiore al 30% del totale dei sofferenti di gonartrosi. Riteniamo utile elencare quelle che, a nostro parere, costituiscono le controindicazioni assolute all’impianto: – la Triade infausta: Obesità con Varismo in Osteoporosi (OVO). – Artrite reumatoide: anche se, in verità, in questi casi morbosi, nella nostra esperienza, abbiamo sempre trovato una degenerazione tricompartimentale, mai mono, come invece qualche autore ha descritto. – Artrosi femoro-patellare importante e, soprattutto, sintomatica. – Lassità combinata grave. – Rigidità in flessione superiore ai 10° o non correggibile.
Importante nell’indicazione e realizzazione dell’impianto e non incorrere in Errori di tecnica: 1) applicazione di piatti tibiali con polietilene inferiore ai 6 mm. di spessore. 2) Ipercorrezione dell’asse frontale (utile non superare con il polietilene l’altezza del piatto controlaterale sano e cercare di portare l’arto inferiore in posizione neutra). 3) Rigidità allo stress del comparto (utile un piccolo release, in modo da lasciare un gioco di circa 2 mm in varo-valgo) 4) Non correggere le patologie dell’anca associate, prima dell’impianto al ginocchio.
Le casistiche, riportate in letteratura, con queste indicazioni, sono molto incoraggianti. Presentano curve di sopravvivenza superiori al 90% con follow up ormai di lungo termine (Cartier P. 1987, Stockelman R. E. 1991, Christensen N. 0. 1991, Larsson S. E. 1988, Heck D.A. 1993; Newman 1998, Murray, Goodfellow 1998), sovrapponibili a quelle delle totali, con controlli clinici, a distanza di tempo, maggiore (McKinnon J. 1988, Scott R.D. 1991, Witvoet J. 1993, McKenzie J. R. 1993, Cameron H. U. 1988, Rongraff J. R. 1991, Carr A. e Goodfellow J. 1993, Laurencin C. T. e Scott R.D. 1991, Squire 1999; Tabor 1998) e superiori a quelle delle osteotomie (Brangton N. S. e Newman J. H. 1986, Jackson M. e Newman J.H. 1994; Schai P.A. 1998). Sostituiscono, in parte, le prime pubblicazioni che descrivevano insuccessi oltre il 35% (Mallory T.H.1983, Laskin R S. 1978, Insall J. 1980), anche se tutti gli autori concordavano nell’individuare, quale principale causa, la scorretta selezione dei pazienti (Barret W. P., Scott R.D. 1987), riducendone così l’applicazione a non più del 10% di tutte le protesi del ginocchio. Rimangono comuni le cause di fallimento per errori di tecnica chirurgica: imperizia, scorretta correzione delle deformità assiali, cattivo allineamento delle componenti protesiche, errori nella cementazione, utilizzo di polietilene inferiore ai 6 mm. di spessore (Bert J. M. 1997 MeCallum J.D. e Scott R.D. 1995). Per tutte queste ragioni, la curva di apprendimento, rispetto ad altre metodiche, risulta più lunga e spesso scoraggia il chirurgo. Ma, la soddisfazione che la maggioranza dei pazienti esprime, durante i controlli ambulatoriali a distanza di tempo, associata alla constatazione della completa mobilità articolare, del recupero dell’asse anatomico, della stabilità in varo-valgo, dell’assenza del dolore, della zoppia, della facilità nell’alzarsi dalla sedia, nel salire le scale, della possibilità, persino, di correre e saltare, da parte dei più giovani, dovrebbe indurre ad una maggior costanza. Infine, un aspetto difficilmente quantificabile, dal punto di vista scientifico, ma importante per il medico, è la minor preoccupazione con la quale si propone, ai pazienti, l’intervento di sostituzione protesica monocompartimentale, la minor tensione nell’accingersi ad entrare in sala operatoria, quasi sempre contraccambiata dal paziente, tanto che è sempre più facile sorridere del suo problema e l’ottimismo è, forse, la prima medicina. Chirurgo e paziente sanno di correre meno rischi, di ottenere, nelle corrette indicazioni, ottimi risultati, con la possibilità di una agevole ripresa chirurgica, in caso di malaugurato fallimento.
UNI+PFJ (PROTESI DI RIVESTIMENTO BICOMPARTIMENTALE MODULARE) Un approccio che può rappresentare un’alternativa alla protesi di rivestimento bi compartimentale monolitica è dato da una protesi modulare separata femoro-rotulea e femoro-tibiale , in genere mediale, la quale permette di eseguire le tecniche di rivestimento compartimentale indipendentemente, assicurando un corretto orientamento e allineamento delle varie componenti in base al limite coronale e all’asse rotazionale del femore distale: ciò senza che sia compromesso il posizionamento dell’impianto, effettuandolo in base a come la componente è impiantata nell’altro compartimento. Inoltre questo consente anche intercambiabilità di dimensioni tra le componenti in modo da poter stabilire variabilità nella geometria femorale . In aggiunta, effettuare un impianto di rivestimento bicompartimentale modulare è anche tecnicamente più semplice rispetto ad un impianto che preveda l’uso della protesi monolitica. Nel rivestimento bicompartimentale modulare, la grandezza dello spazio presente tra il margine transizionale della componente trocleare e quello prossimale della componente femorale dell’ UKA può variare. Infatti, la distanza può variare tra 1 mm a 15 mm, in base alla forma e alla grandezza del femore distale. Non vengono riscontrati problemi con lo spazio transizionale tra la componente trocleare e la protesi condilare usando un rivestimento con componenti indipendenti, ammesso che gli impianti siano appositamente posizionati a contatto tra loro o separati di circa 1 mm. Margini prominenti possono risultare con l’impianto della componente protesica patellare con fenomeni di catching or snapping e pertanto dovrebbe essere evitati. Un impianto con margine prominente può verificarsi a causa di errori tecnici o difetti nel design dell’impianto. Componenti mal allineate, mal posizionate, di dimensione scorretta o non a contatto con la superficie condilare possono influenzare il tracking rotuleo e avere perciò conseguenze sulla performance rotulea ed la sopravvivenza a lungo-termine dell’ artroplastica bicompartimentale. L’obiettivo è quello di ottimizzare le relazioni tra le componenti e migliorare in maniera efficace il tracking della protesi rotulea dalla componente trocleare a quella femoro-condilare. La chirurgia di ginocchio con risparmio di tessuto —protesi unicompartimentale isolata (UKA) o patellofemorale (PFA)- sta godendo del suo più alto livello di interesse e accettazione da quando è stata introdotta 3 decenni fa. Da un punto di vista storico, l’impianto di UKA e PFJ veniva effettuato in pochi casi solo in centri selezionati; altrove era spesso sostituito dall’impianto totale di ginocchio (TKA), osteotomie correttive, o patellotomie. Oggi, il rivestimento bicompartimentale (UKA +PFJ) viene effettuato più frequentemente, dal momento che i chirurghi hanno preso maggiore confidenza grazie ai risultati riscontrati. I rapidi cambiamenti nella tecnologia e negli approcci chirurgici mininvasivi, e il consenso sempre più esteso del rivestimento parziale di ginocchio, hanno espanso ulteriormente il contemporaneo concetto di risparmio di tessuto nell’artroplastica di ginocchio per includere l’artroplastica bicompartimentale. L’importanza di questa strategia e questi approcci all’artroplastica di ginocchio è di doppio valore: – 1- Innanzi tutto, molti pazienti che si sottopongono alla TKA presentano un quadro di artrosi esclusivamente bicompartimentale che coinvolge il comparto mediale e il femoro-rotuleo o, in minor frequenza, il laterale e femoro-rotuleo: non hanno una deformità significativa, presentano ancora movimento ottimale, e legamenti crociati intatti. Poichè molti di questi pazienti sono giovani e fisicamente attivi, sembra appropriato un approccio che sia più conservativo rispetto alla TKA, particolarmente data la potenziale ridotta durata dell’impianto. – 2-In secondo luogo, una percentuale di pazienti che si sottopone alle PFJ presenta un quadro concomitante di condropatia femoro-tibiale che degenera inevitabilmente poco più tardi in una progressiva artrosi tibio-femorale, al punto che devono spesso essere sostituite da TKA piuttosto che offrire un approccio modulare al rivestimento del comparto degenerato. Allo stesso modo, diverse UNI esitano in relativo insuccesso a causa della presenza di significativa sintomatica o ancora scarsamente sintomatica artrosi della femoro-rotulea , e le ginocchia devono spesso essere sostituite da TKA. – Un vantaggio dell’artroplastica modulare bicompartimentale nei confronti della TKA- a parte la conservazione dell’osso- è la conservazione della propriocettività e della fisiologica cinematica del ginocchio grazie al mantenimento dei legamenti del crociato anteriore e posteriore. – – ln aggiunta, il rivestimento bicompartimentale è un’opzione per pazienti che hanno un quadro avanzato di artrosi bicompartimentali ma non vogliono sottoporsi alla TKA poichè la considerano come ultimo trattamento .
Le protesi parziali di rivestimento vengono scelte in base ai seguenti criteri:
Preparazione all’intervento Comprende:
Iter terapeutico-assistenziale post-operatorio Comprende:
DECORSO POST OPERATORIO
2. Dalla prima giornata post operatoria viene effettuata ove le condizioni cliniche e la tipologia di intervento lo consenta Assistenza Riabilitativa al letto per la correzione della postura e mobilizzazione dell’arto operato, recupero nei trasferimenti e dell’ortostasi. Vengono inoltre fornite al paziente le indicazioni per ottenere la corretta postura al letto e le indicazioni per il recupero nei trasferimenti
Da “Protocollo diagnostico-terapeutico per protesi di ginocchio” Prof. Dr. S. Zanasi, Dott. M. Pastina, Dott. F. Giannone, CS Alessia DE Ambrogio, CS FF Volpe Stefania, CS M. Casacci, Coord. G. Bortolotti
BIBLIOGRAFIA
|
Chirurgia Artroscopica e Protesica Mini Invasiva a cura del Dr. Gaetano Maci
+39 3408486387
gaetano.maci@gmail.com
Chirurgia protesica di Ginocchio
- Home
- Chirurgia mini-invasiva
- Chirurgia protesica di Ginocchio
Page Copyright
© Copyright 2018 All Rights Reserved
