|
PROTESI D’ANCA
|
|||||||||||||||||
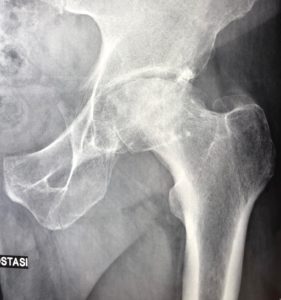 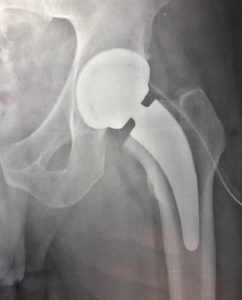
Quando un’articolazione è danneggiata per una qualsiasi patologia (degenerativa, infiammatoria, post-traumatica) (vedi Tabella 1) ed un trattamento conservativo (medico, fisioterapico) non è più in grado di controllare il dolore e la disfunzione è necessario ricorrere ad un trattamento chirurgico.
Tabella 1
Con la protesizzazione dell’anca, le parti usurate o danneggiate dell’articolazione saranno sostituite o rivestite con elementi protesici e, se non sono presenti altre patologie, permetterà un ritmo di vita normale anche se dovranno essere limitate le attività che possono sovraccaricare l’anca operata. Un’anca artificiale tuttavia non è un’articolazione normale anche se ben funzionante. L’intervento di artroprotesi può pertanto richiedere un secondo intervento (correlato a fenomeni di usura della protesi e/o altre patologie dell’osso circostante) in una percentuale di circa il 5-10% nei primi quindici anni dall’impianto.
1.2 Indicazioni II trattamento chirurgico è di norma riservato alle persone oltre i 55-60 anni anche se in casi selezionati in esiti di trauma o microtraumatismo iterativo (baby boomer generation) o di displasia o di osteonecrosi asettica è possibile eseguire questo tipo d’intervento a persone molto giovani. Le principali indicazioni all’intervento sono determinate da: 1. Dolore (se presente tutti i giorni) 2. Deformità 3. Disabilità (se limita il lavoro e/o le comuni attività quotidiane e ricreative) Condizioni che aumentano il rischio operatorio sono:
Condizioni che al momento non permettono l’intervento:
1.3 Prognosi La completa guarigione normalmente richiede circa 45-90 giorni ed è importante effettuare regolarmente gli esercizi imparati durante la riabilitazione a secco ed in acqua. Il ritorno alle comuni attività avviene di norma dopo due mesi (tecnica MIS → mini-invasiva) o tre/quattro mesi (tecnica tradizionale) dall’intervento.
1.4 Iter diagnostico L’iter inizia con una visita ambulatoriale specialistica ortopedica, durante la quale l’ortopedico, in presenza di sintomatologia dolorosa del paziente e se il paziente non sia già in possesso di radiogrammi standard del bacino recenti (che di norma vengono richiesti all’atto della prenotazione della visita ambulatoriale), procederà con esami atti a stabilire la presenza di artrosi di una o delle due anche, nonché la qualità minerale ossea:
Qualora il quadro clinico e radiologico siano già diagnostici per artrosi dell’anca, lo specialista ortopedico provvederà ad inserire il paziente in lista d’attesa per l’intervento (vedi P02 “Procedura di modalità di accesso”) e a sottoporre al paziente il modulo di consenso specifico all’intervento di artroprotesi d’anca (vedi P37 “Procedura di acquisizione del consenso informato”). N.B. In casi dubbi possono essere richiesti ulteriori esami:
1.5 Iter pre-operatorio pre-ricovero Comprende (vedi A.T.I. IO01):
Comprende:
· Scelta della protesi: Utilizziamo protesi NON CEMENTATE che vengono scelte in base ai seguenti criteri:
PROTESI TOTALE DELL’ANCA IN PAZIENTI GIOVANI Il numero di pazienti che soffrono di un problema ortopedico invalidante all’anca è in crescita. Nel 2002 il 18,5% dei pazienti che si sottoponevano a intervento di protesi totale dell’anca primario o di revisione era al di sotto dei 40 anni di età, il 45,4% era più giovane di 60 anni. Questi dati nella filosofia del cd “earlier intervention” sono significativamente aumentati, tanto da rappresentare il 60 % della popolazione protesizzata. I risultati scientifici ottenuti da molti studi indicano che l’usura è inevitabile, con qualsiasi tipo di protesi. Negli impianti ortopedici è inevitabile la formazione di particelle e ioni da usura. Sono elementi determinanti la forma del dispositivo protesico, le proprietà del materiale, la tecnica chirurgica e il livello di attività del paziente. L’usura si verifica in tutti i tipi di protesi e di articolazioni, sebbene in misura diversa in relazione al tipo di materiale che deriva dall’attrito degli accoppiamenti: il movimento della sfera di metallo o ceramica nella cavità di polietilene può causare una intensa usura e condurre all’osteolisi con distacco/mobilizzazione della protesi. Il 90% delle particelle rilasciate hanno diametro inferiore a 1,0 µm. I tessuti circostanti la protesi in distacco contengono circa da 10⁸ a 1000⁹ particelle per grammo a peso asciutto. La risposta locale del sistema immunitario umano a queste particelle è responsabile dell’inizio dell’osteolisi con conseguente scollamento della protesi. Il macrofago umano (cellula del sistema immunitario) ha un ruolo centrale nella reazione biologica alle particelle da usura della protesi. I macrofagi raccolgono queste particelle intracellulari (processo detto fagocitosi) per formare grandi cellule multinucleari estranee. Queste cellule sono in grado di raccogliere particelle più grandi. Questo causa il rilascio di citochine, prodotte da quelle cellule. Le citochine sono mediatori che stimolano gli ostoeclasti (che mangiano l’osso), causando un intenso riassorbimento dell’osso (osteolisi). Sono coinvolti in questo processo molti altri meccanismi cellulari che interessano i fibroblasti, osteoblasti, e cellule staminali. Per ridurre le implicazioni cliniche delle particelle d’usura, si deve cercare di ridurre la produzione delle particelle stesse migliorando il design, i materiali e la tecnica chirurgica. Finché non sono disponibili farmaci specifici per inibire la risposta biologica, l’unico modo di far fronte a questo problema è cercare abbinamenti alternativi. Accoppiamenti alternativi: · Delta Ceramica su Cross-linked “Longevity” Poly · Delta Ceramica su E-poly · Oxinium su XLPE · Delta ceramica su Delta ceramica
Tipo di intervento di protesi: tradizionale o mini-invasivo? Questo argomento è tra quelli che ad oggi stanno più a cuore ai pazienti che vanno a discutere un possibile intervento di protesi all’anca. L’intervento tradizionale di protesi all’anca usa un’incisione variabile in proporzione alla statura del paziente, di solito tra i 14 e i 20 cm di lunghezza, ed è stato praticato per oltre 40 anni, salvo alcune modifiche alla tecnica chirurgica. I risultati di questo metodo sono stati pubblicati da migliaia di chirurghi, centinaia di centri medici, in decine di paesi. Il tasso di successo di questi interventi è noto, ed è superiore al 90% con oltre 10 anni di durata dopo l’intervento. Si può considerare una delle grandi innovazioni chirurgiche del XX secolo. Da questo consegue che per testare qualcosa di totalmente nuovo o sperimentale, gli standard da soddisfare sarebbero molto elevati. Di contro, l’intervento di protesi totale dell’anca mini-invasivo è un approccio chirurgico relativamente nuovo; è effettuato da ca cinque anni da pochi chirurghi. “Mini-invasivo” significa che la stessa operazione è effettuata tramite un’incisione leggermente più piccola rispetto a quella della chirurgia tradizionale (circa 14 cm contro 20) o addirittura con un incisione molto più piccola, secondo il metodo adottato, di circa 8 cm o 5 cm con chirurgia computer-assistita CT free. In realtà il concetto oggi di mininvasività non significa la limitazione della lunghezza della incisione cutanea ma il realtà il SIGNIFICA RISPARMIO ASSOLUTO DI TUTTI I TESSUTI NON INTERESSATI DALLA PATOLOGIA (TISSUE SPARING CONCEPT) : per cui ad esempio, per accedere alla articolazione non si distaccano muscoli, passando attraverso gli stessi per via smussa e si reseca solo la testa deformata, conservando tutto il collo del femore. Benefici della chirurgia mini invasiva Sebbene la chirurgia mini invasiva offra ai pazienti benefici come incisioni più piccole, degenza ospedaliera più breve, minore perdita di sangue, dolore ridotto nella fase post-operatoria, carico fisiologico, recupero post-operatorio rapido, molti chirurghi ortopedici sono ancora dibattuti sulla possibile minore durata nel lungo termine rispetto al metodo tradizionale “aperto”. Il problema è che questi elementi non sono ad oggi ancora dimostrati da significativi studi scientifici a medio e lungo termine. In verità non siamo in grado di garantire che con un’incisione più corta, e mantenedo la totale lunghezza del collo femorale i risultati siano gli stessi, anche se per le giovani pazienti donne una cicatrice più piccola è preferibile, ed i vantaggi di conservare il collo sono ovvi dal pdv biomeccanico e dal pdv della eventuale revisione chirurgica. Se un’incisione più corta, o la conservazione del collo non permetteno al chirurgo di vedere chiaramente la cavità dell’anca o il femore, o se impedisce di lavorare bene dal punto di vista chirurgico, il risultato potrebbe essere un errato posizionamento dei componenti della protesi, con complicazioni chirurgiche come fratture o lesione di nervi, lussazioni dell’anca e usura precoce della superficie dell’articolazione artificiale. Al contrario, la protesi parziale del ginocchio con tecnica mini invasiva, praticata solo da qualche anno in più rispetto alla tecnica dell’anca, ha già una quantità di studi che dimostrano un rapido recupero dei pazienti, e l’abilità dei chirurghi a posizionare bene i componenti attraverso la piccola incisione. Come spesso accade in medicina e chirurgia, si tratta di scelte personali da fare una volta presi in considerazione tutti gli elementi.
MIS e conservazione del collo femorale Le protesi a conservazione di collo sono stati progettate appositamente per pazienti biologicamente giovani, attivi, che a causa della lunga aspettativa di vita avrebbero dovuto aspettarsi una probabilità di scollamento asettico superiore alla media. Si è osservato che i carichi biomeccanici e i principi di fissazione derivati dall’anatomia dell’anca e dai modelli fisiologici tendono a estendersi al concetto di ritenzione del collo femorale e tecniche di fissazione senza cemento. Così è stato sviluppato un ancoraggio dell’impianto stabile, resistente ai carichi, che offre le migliori condizioni per eventuali interventi successivi. Per biologicamente giovane si intende da 65 anni in giù, buona qualità delle ossa, aspettativa di vita lunga associata a attività dinamica quotidiana. In questi pazienti è molto alta l’incidenza di scollamento asettico in associazione all’intervento tradizionale di protesi all’anca. In questi casi la protesi a conservazione di collo rappresenta il mini-impianto ideale per i giovani pazienti affetti da artrosi primaria o secondaria post traumatica, da artrite reumatoide, e da necrosi della testa femorale. Questo non solo per la ridotta incisione ma anche per il fatto che consente la conservazione della struttura muscolare e specialmente della porzione laterale del collo e del calcar. Dal punto di vista meccanico, un impianto che protegge il collo femorale garantisce: -massima stabilità tripolare, soprattutto per forze di torsione -Fissazione prossimale ottimale dell’osso spugnoso metafiseale (ruolo di sistemi elastici di distribuzione pressione) -Distribuzione uniforme e corretta dei carichi sulle forze fisiologiche (orientamento fisiologico della trabecola) con osteo-integrazione e rimodellamento positivo dell’osso dovuto al mantenimento dell’architettura e delle strutture dell’osso. -La conservazione o l’aumento dell’offset e del braccio di leva: l’aumento dell’offset in particolare si traduce nella riduzione del carico sul coxofemorale e in una riduzione teorica dell’uso di polietilene (Devane 1999), che consente più lunga durata dell’impianto. Da un punto di vista biologico, l’impianto garantisce: -La conservazione di una riserva di osso che garantisce una base di osso più ampia in caso di un intervento di revisione, o di un seconda protesi -La conservazione dell’osso spugnoso metafiseale con conseguente facilità di rimozione dell’impianto, se necessario, e di posizionamento di un nuovo impianto -La conservazione della vascolarizzazione endostale, diversamente da come avviene con le tecniche tradizionali dove i maggiori contribuenti ematici al femore prossimale vengono ri-sezionati alle ramificazioni terminali dell’arteria circostante.
Opzioni chirurgiche: materiali e superfici (polietilene, metallo, ceramica) Di cosa sono fatte le protesi dell’anca? I materiali usati per la sostituzione dell’anca sono stati sviluppati con le massime tecnologie esistenti, per garantire compatibilità e tolleranza estrema con il corpo umano nel lungo termine. Si parla di materiali “bio-compatibili”. In genere esistono 3 tipi di materiale usati nel campo ortopedico: metalli, polimeri (plastica), ceramica. Le protesi sono sottoposte a grandi carichi del peso del corpo e per questo devono avere la resistenza tipica dei materiali a tecnologia avanzata, che possono sopportare i carichi ciclici a cui il materiale viene sottoposto durante gli anni di utilizzo. Gli steli per il femore sono forgiati a calore per conferire la resistenza necessaria. Inizialmente i metalli venivano fusi ma oggi la forgiatura a calore si è affermata come miglior procedimento per ottenere risultati eccellenti da questi materiali, una volta impiantati. Tutte le protesi all’anca, nella componente dello stelo e della cavità acetabolare, sono generalmente fatte di lega di titanio e niobio. Di recente è stata realizzata una cavità acetabolare con la tecnologia del metallo trabecolare (componente acetabolare in trabecolar metal): la struttura macroporosa del metallo trabecolare* somiglia all’osso e si avvicina alle sue proprietà fisiche e meccaniche più di qualsiasi altro materiale prostetico.
Superfici di accoppiamento I materiali usati nell’accoppiamento tra testa e cavità acetabolare, potenzialmente influiscono sulla durata nel lungo termine della protesi dell’articolazione. Questa è un’altra area in cui la tecnologia potrebbe cambiare radicalmente l’esito di un intervento. Secondo come si muoveranno i ricercatori in quest’area, la protesi all’anca potrebbe avere tutt’altro aspetto tra dieci anni rispetto ad oggi. Negli ultimi 50 anni circa, ovvero da quando si effettua la protesi all’anca, si sono provati molti rivestimenti superficiali diversi. E molti non hanno avuto successo. Per questo è importante procedere con cautela, considerando che l’accoppiamento per l’articolazione (metallo su polietilene) che adesso è più usato, ha radici negli anni ’60.
Il polietilene è una resina plastica duratura e ad elevate prestazioni. È scivoloso (motivo per cui funziona bene in un’articolazione mobile come l’anca), ma si sa che è soggetto a consumo. Infatti, anche se oltre il 90% delle protesi metallo su polietilene (le più diffuse al giorno d’oggi) funzionano per più di 10 anni, molte di esse non durano fino a 20. E quando la plastica si consuma spesso si ha una reazione distruttiva che porta ad una perdita di osso intorno all’articolazione: i detriti di polietilene si diffondono intorno alla protesi e alle cellule, chiamate macrofagi, preposte ad eliminare questi corpi estranei: inglobandoli, corrodono l’osso attorno alla protesi causando un fenomeno di mobilizzazione della protesi. Nelle protesi totali all’anca sono stati usati molti materiali diversi, ma solo uno ha superato la prova del tempo: il polietilene ad altissimo peso molecolare. La ceramica su ceramica è stata introdotta del 1970. La caratteristica più significativa di questo accoppiamento è la sua natura bioinerte. In circostanze normali (circostanze biomeccaniche ideali dopo l’impianto), l’usura dei componenti meccanici è minima. La reazione biologica è ridotta al minimo e consiste nella presenza di tessuto fibroso con un bassissimo numero di macrofagi e cellule giganti. Tuttavia, quando le condizioni meccaniche dei componenti sono meno ideali (per esempio in caso di frattura o lussazione di un componente), ci sarà una reazione biologica più ampia causata dal numero crescente di particelle da usura. Inoltre la ceramica su ceramica è attualmente l’unico accoppiamento che ha miglior tasso di sopravvivenza nei pazienti giovani (<50 anni) in confronto a quelli più anziani: l’ 86% di durata oltre 15 anni, si spiega anche con la migliore qualità dell’osso in tali pazienti. Attualmente il rischio di frattura del componente in ceramica di nuova generazione (DELTA CERAMICA) è inferiore a 1 su 2000 impianti in un periodo di 10 anni (1/20000). All’inizio il rischio era dell’1%! . Le superfici di accoppiamento in ceramica si usano pertanto di solito in pazienti giovani. Metallo su metallo: gli impianti con accoppiamento articolare metallo-su-metallo sono stati utilizzati in oltre 300.000 sostituzioni totali dell’anca. Le caratteristiche tribologiche perfezionate dei nuovi accoppiamenti metallo-su-metallo sono alla base del successo dei nuovi disegni. Sebbene l’importanza di ciascun fattore sia poco chiara, i principali elementi tribologici riconosciuti sono: ridotta ruvidità delle superfici, migliore scorrevolezza, minore clearance (differenza diametrale tra testa femorale e coppa acetabolare), lega CoCr più resistente e maggiore contenuto di carbonio. Durante i primi due anni di” lavoro” entrambe le superfici metalliche dell’articolazione vengono levigate “in vivo”, e rilasciano un elevato numero di ioni di metallo e particelle. Dopo 1 o due anni (= 1 o 2 milioni di cicli), si raggiunge una fase di stabilità caratterizzata da un’usura minima costante. A causa del sottile strato fluido tra le superfici metalliche, l’area di contatto tra i componenti è sempre inferiore a 2 mm², e talvolta si riduce anche fino a zero per la continua levigatura. Diversi risultati clinici hanno riportato un tasso di sopravvivenza fino al 100% a 60 mesi (follow-up medio di 5 anni) e fino al 93% a 120 mesi (follow-up medio di 10 anni). Tuttavia, permangono delle preoccupazioni in merito alle conseguenze biologiche del rilascio di metallo, inclusi i potenziali effetti locali e sistemici consequenti agli innalzamenti cronici dei valori sierici di cromo e cobalto e all’eccessiva produzione di detriti metallici. L’analisi radiografica e i livelli degli ioni metallici sono considerati le misurazioni di riferimento utilizzate per agevolare la diagnosi di fallimento precoce dell’impianto e di complicanze riguardanti i tessuti molli, anche in pazienti asintomatici.
Scelta del dispositivo: Rischi e Benefici I dispositivi attualmente disponibili per la protesi totale dell’anca si sono evoluti grazie alla conoscenza accumulata i decenni di prove di laboratorio ed esperienza clinica. Tutti gli accoppiamenti esistenti presentano benefici e rischi che devono essere ben valutati quando si deve abbinare il singolo individuo alla portesi più adatta. Mettendo a confronto i dispositivi per uno specifico candidato, è importante utilizzare i criteri pertinenti e, nei limiti del possibile, prove oggettive. La decisione più importante nella scelta della superficie è relativa a quale accoppiamento abbia più probabilità di garantire al paziente un rischio accettabilmente basso di un intervento di revisione nel corso della sua vita. I dati clinici di breve termine indicano un livello di riduzione dell’usura con polietilene reticolato che si avvicina a quelli dimostrati dagli studi di simulazione dell’usura dell’anca. Tuttavia, sono necessari studi successivi per sapere se l’osteolisi sia adeguatamente ridotta. Gli accoppiamenti metallo su metallo di ampio diametro combinano alta resistenza all’usura, un elevato range di movimento e alta stabilità, tollerando meglio il carico d’impatto: non sono documentati fratture o danni strutturali. Gli accoppiamenti metallo su metallo sono controindicati in pazienti con insufficienza renale, e rimangono perplessità riguardo all’aumento dei livelli di ioni di cobalto e cromo. Gli accoppiamenti ceramica su ceramica hanno caratteristiche d’usura superiori, senza problemi di aumento di esposizione agli ioni, che può essere importante per certi pazienti, come le donne in età fertile. Questa tecnologia ha però limiti di diametro delle componenti dell’accoppiamento, superati con il sistema MAXERA CUP, Zimmer e rischi di frattura, anche se ridotti con l’utilizzo della ceramica delta. Molti produttori distribuiscono sistemi modulari con inserto acetabolare compatibile di polietilene, metallo o ceramica. In abbinamento ad uno stelo dello stesso produttore, è possibile per il chirurgo cambiare accoppiamento senza cambiare l’impianto. Con l’evoluzione dell’esperienza clinica e delle tecnologia degli accoppiamenti, questi sistemi offrono vantaggi sia per il paziente che per il chirurgo. Il rinnovato interesse per le articolazioni in metallo su metallo è legato all’obiettivo di estendere la durata dell’impianto in pazienti relativamente giovani, più soggetti a intervento di revisione per usura del polietilene e osteolisi. Un fattore importante che guida lo sviluppo di accoppiamenti alternativi, é proprio il desiderio di evitare interventi di revisione per qualsiasi motivo (usura, osteolisi, distacco, lussazione, …). L’intervento di revisione della protesi è associato a rischi significativi. Stando ai dati di Medicare, la mortalità a 90 giorni è del 2,6%, percentuale molto più alta di quella prevista dopo l’intervento primario all’anca, dovuto all’importanza e alla complessità dell’intervento di revisione I pazienti vivono di più e richiedono maggior funzionalità. Gli sforzi per testare ulteriormente il limiti entro cui la protesi dell’anca può ripristinare le funzionalità fanno da stimolo per lo sviluppo di dispositivi più duraturi, obiettivo che oggi dipende dai miglioramenti della superficie di accoppiamento. I dispositivi metallo su metallo possono offrire la migliore opportunità di raggiungere questo obiettivo. La validità di questo approccio è supportata da oltre 40 anni di esperienza clinica. Solo il tempo potrà dire se l’attuale generazione di dispositivi possa rispondere alle esigenze dei pazienti di oggi. Anche se nei primi anni di pratica della protesi all’anca le prime protesi con accoppiamento metallo su metallo sono state sostituite da protesi metallo su polietilene con minore incidenza di distacco, successivamente i vantaggi dei cuscinetti metallo su metallo sono stati riconosciuti. Tra questi la bassa usura ed un basso rischio di osteolisi. Gli accoppiamenti metallo su metallo non si fratturano e permettono ampio diametro per maggiore libertà di movimento e stabilità, estendendo la capacità funzionale della protesi dell’anca. Informazioni relative all’esposizione agli ioni di metallo si possono trarre dalle protesi di prima generazione, alcune delle quali hanno continuato a funzionare bene dopo 30 anni; sono inoltre disponibili dati a 15 anni relativi all’impianto di dispositivi iniziali della seconda generazione. Gli accoppiamenti metallo su metallo si dovrebbero evitare in pazienti con insufficienza renale effettiva o potenziale. Raramente si verifica ipersensibilità al metallo impiantato. I sospetti teorici relativi a tossicità organica e carcinogenesi si sono attenuate per l’assenza di casi documentati. I dati aggregati dimostrano un rapporto rischio-beneficio favorevole ed il potenziale delle articolazioni metallo su metallo di espandere la capacità funzionale della protesi all’anca e di aumentare il numero di candidati idonei per questa tecnologia.
FISSAZIONE DELLA PROTESI Le maggiori differenze fra anca normale ed anca protesizzata si verificano soprattutto per il sovvertimento della distribuzione delle tensioni nella zona prossimo-mediale del femore. Infatti nelle articolazioni naturali, le forze vengono trasmesse alle strutture dell’osso spongioso e corticale attraverso le superfici articolari, le inserzioni muscolari e quelle legamentose: l’inserimento di una protesi altera questa distribuzione e crea sollecitazioni che non hanno alcun corrispettivo fisiologico • le deformazioni longitudinali, nella regione ossea prossimo-mediale, sono inferiori a quelle fisiologiche, mentre sono superiori nella parte distale, • le deformazioni circonferenziali, sono più elevate, rispetto ai valori “fisiologici“ • sono presenti elevate sollecitazioni torsionali intorno all’asse longitudinale della protesi • all’interfaccia osso-impianto si hanno sollecitazioni di taglio e compressione Mentre nei femori intatti la massima sollecitazione si ha a livello prossimo-mediale, nei femori protesizzati la distribuzione dei carichi è diversa: si osserva una marcata riduzione delle sollecitazioni nella zona prossimo-mediale. Attualmente esistono fondamentalmente due metodi di fissazione della protesi all’osso che offrono stabilità ed evitano il movimento tra protesi e osso.
• CEMENTO OSSEO (=polimetacrilato di metile o PMMA) • PRESS-FIT: si ottiene posizionando a pressione un dispositivo leggermente più grande su un asse o su un cavità leggermente più piccole: usa una protesi in metallo prodotta con una superficie speciale (per esempio rivestimento poroso, superficie ruvida) che favorisce la crescita dell’osso nella e sulla superficie. Per velocizzare o migliorare il fissaggio all’osso si usano anche rivestimenti extra della superficie, come idrossipatite. Le protesi d’anca non cementate sono realizzate per la maggior parte dei casi in lega di titanio (Ti6Al4V): il chirurgo ortopedico, usando una serie di raspe di geometria adatta per ogni forma e misura di protesi, scava nell’osso una cavità che ha la forma della protesi stessa, ma leggermente più piccola. Inserisce poi la protesi forzandola nella cavità, stabilendo l’ancoraggio primario. La stabilità dell’impianto diminuisce nel corso delle prime ventiquattro ore post-operatorie a causa delle elevate pressioni cui è sottoposto l’osso. Nei successivi quindici-trenta giorni l’osso ricresce attorno alla protesi e in particolare all’interno delle piccole cavità che vengono realizzate sulla superficie della zona diafisaria. Il mese successivo all’operazione è critico, in quanto occorre una riabilitazione appropriata che mantenga la muscolatura tonica, sottoponendo l’articolazione a carichi programmati, crescenti con il tempo. In questo periodo, infatti, l’osso ricresce, fino a stabilire una continuità con la protesi Il vantaggio principale di questo tipo di impianto è una durata maggiore rispetto a quelli cementati. Se l’intervento è ben eseguito e non ci sono problemi di altro tipo, la durata prevista è superiore a quella media delle protesi cementate. Il principale obiettivo delle protesi non cementate è l’osteointegrazione, ossia il contatto diretto (meccanicamente stabile) fra protesi e osso senza tessuto interconnettivo interposto. Il grado di osteointegrazione dipende dalla forma e dalle dimensioni della protesi, dalle modalità e dai materiali con i quali è fabbricata, dalle sue caratteristiche superficiali e dal tipo di intervento chirurgico. È molto importante garantire che la superficie di contatto tra stelo e canale osseo sia la più ampia possibile per evitare l’insorgere di stress localizzati o fenomeni di riassorbimento osseo (laddove il contatto non esiste) Utilizziamo esclusivamente impianti non cementati: per perdite di sostanza o riempimento di gaps durante l’impianto si associano, in base alle necessità, soprattutto in esiti di displasie, eventuale utilizzo di innesti ossei (BdO) o sostituti ossei (HA) o “compensation wedge” (tantalio).
Preparazione all’intervento Comprende: · Impostazione della profilassi antibiotica.
Iter terapeutico-assistenziale post-operatorio Comprende:
Da “Protocollo diagnostico-terapeutico per protesi di anca” Prof. Dr. S. Zanasi, Dott. M. Pastina, Dott. F. Giannone, CS Alessia DE Ambrogio, CS FF Volpe Stefania, CS M. Casacci, Coord. G. Bortolotti
BIBLIOGRAFIA F. Pipino CFP prosthetic stem in mini-invasive total hip arthroplasty Journal of Orthopaedics and Traumatology Volume 5, Number 3 (2004), 165-171, DOI:10.1007/s10195-004-0065-2 Daniel Briem, Michael Schneider, Nicole Bogner, Nadine Botha and Matthias Gebauer, et al. Mid-term results of 155 patients treated with a collum femoris preserving (CFP) short stem prosthesis International Orthopaedics Pages 655-660(2011) Melanie Nowak, Tobias E. Nowak, Rainer Schmidt, Raimund Forst, Alexander M. Kress and Lutz A. MuellerProspective study of a cementless total hip arthroplasty with a collum femoris preserving stem and a trabeculae oriented pressfit cup: minimun 6-year follow-up Archives of Orthopaedic and Trauma Surgery Volume 131, Number 4 (2011), 549-555, DOI:10.1007/s00402-010-1189-x The five-year results of the Birmingham Hip Resurfacing arthroplasty: an independent series. Steffen RT, Pandit HP, Palan J, Beard DJ, Gundle R, McLardy-Smith P, Murray DW, Gill HS. J Bone Joint Surg Br. 2008 Apr;90(4):436-41.
Heilpern GN, Shah NN, Fordyce MJ. J Bone Joint Surg Br. 2008 Sep;90(9):1137-42.
The early outcome of Birmingham hip resurfacing: an independent Thai surgeon experiences. Larbpaiboonpong V, Turajane T, Pragtong P. J Med Assoc Thai. 2009 Dec;92 Suppl 6:S134-40.
Birmingham hip resurfacing at a mean of ten years: results from an independent centre. Coulter G, Young DA, Dalziel RE, Shimmin AJ. J Bone Joint Surg Br. 2012 Mar;94(3):315-21.
Pollard TC, Baker RP, Eastaugh-Waring SJ, Bannister GC. J Bone Joint Surg Br. 2006 May;88(5):592-600.
Birmingham hip resurfacing: a minimum follow-up of ten years. Treacy RB, McBryde CW, Shears E, Pynsent PB. J Bone Joint Surg Br. 2011 Jan;93(1):27-33.
Metal-on-metal hip resurfacing for obese patients. Le Duff MJ, Amstutz HC, Dorey FJ. J Bone Joint Surg Am. 2007 Dec;89(12):2705-11.
Digas G, Karrholm J, Thanner J, Malchau H, Herberts P. The Otto Aufranc Award. Highly cross-linked polyethylene in total hip arthroplasty: randomized evaluation of penetration rate in cemented and uncemented sockets using radiostereometric analysis. Clin Orthop Relat Res2004;429:6-16.
Grigoris P, Roberts P, Panousis K, Jin Z. Hip resurfacing arthroplasty: the evolution of contemporary designs. Proc Inst Mech Eng H2006;220:95-105.
Australian National Joint Replacement Registry. Demographics of hip and knee arthroplasty. 2010. www.dmac.adelaide.edu.au/aoanjrr/documents/aoanjrrreport_2010.pdf.
Cuckler JM. The optimal metal-metal arthroplasty is still a total hip arthroplasty: in the affirmative. J Arthroplasty2006;21:74-6.
Treacy RB, McBryde CW, Pynsent PB. Birmingham hip resurfacing arthroplasty. A minimum follow-up of five years. J Bone Joint Surg Br2005;87:167-70.
Pollard TC, Baker RP, Eastaugh-Waring SJ, Bannister GC. Treatment of the young active patient with osteoarthritis of the hip. A five- to seven-year comparison of hybrid total hip arthroplasty and metal-on-metal resurfacing. J Bone Joint Surg Br2006;88:592-600.
Lingard EA, Muthumayandi K, Holland JP. Comparison of patient-reported outcomes between hip resurfacing and total hip replacement. J Bone Joint Surg Br2009;91:1550-4.
Vail TP, Mina CA, Yergler JD, Pietrobon R. Metal-on-metal hip resurfacing compares favorably with THA at 2 years followup. Clin Orthop Relat Res2006;453:123-31.
Achten J, Parsons NR, Edlin RP, Griffin DR, Costa ML. A randomised controlled trial of total hip arthroplasty versus resurfacing arthroplasty in the treatment of young patients with arthritis of the hip joint. BMC Musculoskeletal Dis2010;11:8.
Loughead JM, Chesney D, Holland JP, McCaskie AW. Comparison of offset in Birmingham hip resurfacing and hybrid total hip arthroplasty. J Bone Joint Surg Br2005;87:163-6.
Vendittoli PA, Lavigne M, Girard J, Roy AG. A randomised study comparing resection of acetabular bone at resurfacing and total hip replacement. J Bone Joint Surg Br2006;88:997-1002.
Garbuz DS, Tanzer M, Greidanus NV, Masri BA, Duncan CP. The John Charnley Award: metal-on-metal hip resurfacing versus large-diameter head metal-on-metal total hip arthroplasty: a randomized clinical trial. Clin Orthop Relat Res2010;468:318-25.
Lavigne M, Therrien M, Nantel J, Roy A, Prince F, Vendittoli PA. The John Charnley Award: the functional outcome of hip resurfacing and large-head THA is the same: a randomized, double-blind study. Clin Orthop Relat Res2010;468:326-36.
Vendittoli PA, Roy A, Mottard S, Girard J, Lusignan D, Lavigne M. Metal ion release from bearing wear and corrosion with 28 mm and large-diameter metal-on-metal bearing articulations: a follow-up study. J Bone Joint Surg Br2010;92:12-9.
Skinner J, Kay P. Commentary: metal on metal hips. BMJ2011;342:d3009.
National Joint Registry for England and Wales. Prostheses used in hip, knee and ankle replacement procedures. 2010. www.njrcentre.org.uk/NjrCentre/LinkClick.aspx?fileticket=lgUspxM82lk%3d&tabid=86&mid=523.
Smith SL, Dowson D, Goldsmith AA. The effect of femoral head diameter upon lubrication and wear of metal-on-metal total hip replacements. Proc Inst Mech Eng H2001;215:161-70.
Wilmshurst P. The regulation of medical devices. BMJ2011;342:d2822.
Australian Orthopaedic Association. Annual report hip and knee replacement. 2011. www.dmac.adelaide.edu.au/aoanjrr/documents/AnnualReports2011/Lay_Summary_2011.pdf.
Kalairajah Y, Azurza K, Hulme C, Molloy S, Drabu KJ. Health outcome measures in the evaluation of total hip arthroplasties—a comparison between the Harris hip score and the Oxford hip score. J Arthroplasty2005;20:1037-41.
Giannini S, Cadossi M, Chiarello E, Faldini C, Moroni A, Romagnoli M. Hip Int. 2011 Jan-Mar;21(1):52-8.
Larbpaiboonpong V, Turajane T, Sisayanarane T. J Med Assoc Thai. 2009 Dec;92 Suppl 6:S120-7.
The influence of head size and sex on the outcome of Birmingham hip resurfacing. McBryde CW, Theivendran K, Thomas AM, Treacy RB, Pynsent PB. J Bone Joint Surg Am. 2010 Jan;92(1):105-12.
Birmingham hip resurfacing: the prevalence of failure. Carrothers AD, Gilbert RE, Jaiswal A, Richardson JB. J Bone Joint Surg Br. 2010 Oct;92(10):1344-50.
Dorr LD, Wan Z, Longjohn DB, Dubois B, Murken R. J Bone Joint Surg Am. 2000 Jun;82(6):789-98.
Baker RP, Pollard TC, Eastaugh-Waring SJ, Bannister GC. J Bone Joint Surg Br. 2011 Feb;93(2):158-63.
Metal-on-metal hybrid surface arthroplasty: two to six-year follow-up study. Amstutz HC, Beaulé PE, Dorey FJ, Le Duff MJ, Campbell PA, Gruen TA. J Bone Joint Surg Am. 2004 Jan;86-A(1):28-39.
Radiographic changes of the femoral neck after total hip resurfacing. Laffosse JM, Aubin K, Lavigne M, Roy A, Vendittoli PA. Orthop Traumatol Surg Res. 2011 May;97(3):229-40. Epub 2011 Apr 1.
Hip resurfacings revised for inflammatory pseudotumour have a poor outcome. Grammatopolous G, Pandit H, Kwon YM, Gundle R, McLardy-Smith P, Beard DJ, Murray DW, Gill HS. J Bone Joint Surg Br. 2009 Aug;91(8):1019-24.
Metal-on-metal hip resurfacing with an uncemented femoral component. A seven-year follow-up study. Gross TP, Liu F. J Bone Joint Surg Am. 2008 Aug;90 Suppl 3:32-7.
Metal-on-metal total hip resurfacing arthroplasty in the presence of extra-articular deformities or implants. Mont MA, McGrath MS, Ulrich SD, Seyler TM, Marker DR, Delanois RE. J Bone Joint Surg Am. 2008 Aug;90 Suppl 3:45-51.
Bose VC, Baruah BD. J Bone Joint Surg Br. 2010 Jul;92(7):922-8.
Ollivere B, Duckett S, August A, Porteous M. Int Orthop. 2010 Jun;34(5):631-4. Epub 2009 Jun 9.
Results of metal-on-metal hybrid hip resurfacing for Crowe type-I and II developmental dysplasia. Amstutz HC, Antoniades JT, Le Duff MJ. J Bone Joint Surg Am. 2007 Feb;89(2):339-46.
Functional results of isolated femoral revision of hip resurfacing arthroplasty. Gilbert RE, Cheung G, Carrothers AD, Meyer C, Richardson JB. J Bone Joint Surg Am. 2010 Jul 7;92(7):1600-4.
Is resurfacing arthroplasty appropriate for posttraumatic osteoarthritis? Johnson AJ, Zywiel MG, Maduekwe UI, Liu F, Mont MA, Gross TP. Clin Orthop Relat Res. 2011 Jun;469(6):1567-73.
Metal-on-metal hybrid surface arthroplasty. Surgical Technique. Amstutz HC, Beaulé PE, Dorey FJ, Le Duff MJ, Campbell PA, Gruen TA. J Bone Joint Surg Am. 2006 Sep;88 Suppl 1 Pt 2:234-49.
Holland JP, Langton DJ, Hashmi M. J Bone Joint Surg Br. 2012 Apr;94(4):471-6.
Kim YH, Kim JS, Cho SH. J Arthroplasty. 1999 Aug;14(5):538-48.
Suckel A, Geiger F, Kinzl L, Wulker N, Garbrecht M. J Arthroplasty. 2009 Sep;24(6):846-53. Epub 2008 Sep 11.
Minimum ten-year results of primary bipolar hip arthroplasty for degenerative arthritis of the hip. Pellegrini VD Jr, Heiges BA, Bixler B, Lehman EB, Davis CM 3rd. J Bone Joint Surg Am. 2006 Aug;88(8):1817-25.
Gravius S, Mumme T, Weber O, Berdel P, Wirtz DC. Oper Orthop Traumatol. 2009 Dec;21(6):586-601. German.
Outcome of hip resurfacing arthroplasty in patients with developmental hip dysplasia. Naal FD, Schmied M, Munzinger U, Leunig M, Hersche O. Clin Orthop Relat Res. 2009 Jun;467(6):1516-21. Epub 2008 Aug 22.
Birmingham hip resurfacing arthroplasty. A minimum follow-up of five years. Treacy RB, McBryde CW, Pynsent PB. J Bone Joint Surg Br. 2005 Feb;87(2):167-70.
Eskelinen A, Remes V, Helenius I, Pulkkinen P, Nevalainen J, Paavolainen P. Acta Orthop. 2006 Feb;77(1):57-70.
Is there a new learning curve with transition to a new resurfacing system? Johnson AJ, Costa CR, Naziri Q, Mont MA. Bull NYU Hosp Jt Dis. 2011;69 Suppl 1:S16-9.
Metal-on-metal hip arthroplasty in patients thirty years of age or younger. Girard J, Bocquet D, Autissier G, Fouilleron N, Fron D, Migaud H. J Bone Joint Surg Am. 2010 Oct 20;92(14):2419-26.
Birmingham hip resurfacing: five to eight year results. Reito A, Puolakka T, Pajamäki J. Int Orthop. 2011 Aug;35(8):1119-24. Epub 2010 Jun 19.
Ten-year results of a double-heat-treated metal-on-metal hip resurfacing. Daniel J, Ziaee H, Kamali A, Pradhan C, Band T, McMinn DJ. J Bone Joint Surg Br. 2010 Jan;92(1):20-7.
Use of metal-on-metal total hip resurfacing for the treatment of osteonecrosis of the femoral head. Mont MA, Seyler TM, Marker DR, Marulanda GA, Delanois RE. J Bone Joint Surg Am. 2006 Nov;88 Suppl 3:90-7.
Korovessis P, Petsinis G, Repanti M. Arch Orthop Trauma Surg. 2003 Feb;123(1):5-11. Epub 2002 Dec 19.
Gross TP, Liu F. J Orthop Surg Res. 2012 Jan 10;7:1.
McMinn, Derek J. W., Daniel Joseph, Pynsent Paul, Pradhan Chandra Mini-incision Resurfacing Arthroplasty of Hip through the Posterior Approach Clinical Orthopaedics & Related Research: December 2005 – Volume 441 – Issue – pp 91-98 doi: 10.1097/01.blo.0000192034.37049.83 SECTION I: SYMPOSIUM: Papers Presented at the Hip Society Meeting 2005 Daniel J, Ziaee H, Pradhan C, Pynsent PB, McMinn DJ. J Bone Joint Surg Br. 2007 Feb;89(2):169-73.
Daniel J, Ziaee H, Pradhan C, McMinn DJ. J Bone Joint Surg Br. 2009 Feb;91(2):176-9.
Antoniou J, Zukor DJ, Mwale F, Minarik W, Petit A, Huk OL. J Bone Joint Surg Am. 2008 Aug;90 Suppl 3:142-8.
Hart AJ, Buddhdev P, Winship P, Faria N, Powell JJ, Skinner JA. Hip Int. 2008 Jul-Sep;18(3):212-9.
Systemic metal exposure in large- and small-diameter metal-on-metal total hip replacements. Daniel J, Ziaee H, Pradhan C, McMinn DJ. Orthopedics. 2008 Dec;31(12 Suppl 2). pii: orthosupersite.com/view.asp?rID=37189.
The effect of the diameter of metal-on-metal bearings on systemic exposure to cobalt and chromium. Daniel J, Ziaee H, Salama A, Pradhan C, McMinn DJ. J Bone Joint Surg Br. 2006 Apr;88(4):443-8.
Smolders JM, Hol A, Rijnberg WJ, van Susante JL. Acta Orthop. 2011 Oct;82(5):559-66.
Witzleb WC, Ziegler J, Krummenauer F, Neumeister V, Guenther KP. Acta Orthop. 2006 Oct;77(5):697-705.
Ziaee H, Daniel J, Datta AK, Blunt S, McMinn DJ. J Bone Joint Surg Br. 2007 Mar;89(3):301-5.
Smolders JM, Bisseling P, Hol A, Van Der Straeten C, Schreurs BW, van Susante JL. Hip Int. 2011 Sep-Oct;21(5):587-95. doi: 10.5301/HIP.2011.8643.
Vendittoli PA, Roy A, Mottard S, Girard J, Lusignan D, Lavigne M. J Bone Joint Surg Br. 2010 Jan;92(1):12-9.
Heisel C, Streich N, Krachler M, Jakubowitz E, Kretzer JP. J Bone Joint Surg Am. 2008 Aug;90 Suppl 3:125-33.
Engh CA Jr, MacDonald SJ, Sritulanondha S, Thompson A, Naudie D, Engh CA. Clin Orthop Relat Res. 2009 Jan;467(1):101-11. Epub 2008 Oct 15.
deSouza RM, Parsons NR, Oni T, Dalton P, Costa M, Krikler S. J Bone Joint Surg Br. 2010 Dec;92(12):1642-7.
Bernstein M, Gupta S, Petit A, Zukor DJ, Huk OL, Antoniou J. Bull NYU Hosp Jt Dis. 2011;69 Suppl 1:S20-6.
Garbuz DS, Tanzer M, Greidanus NV, Masri BA, Duncan CP. Clin Orthop Relat Res. 2010 Feb;468(2):318-25. Epub 2009 Aug 21.
Holland JP, Langton DJ, Hashmi M. J Bone Joint Surg Br. 2012 Apr;94(4):471-6.
Do ion levels in hip resurfacing differ from metal-on-metal THA at midterm? Moroni A, Savarino L, Hoque M, Cadossi M, Baldini N. Clin Orthop Relat Res. 2011 Jan;469(1):180-7. Epub 2010 Jun 11.
Does ion release differ between hip resurfacing and metal-on-metal THA? Moroni A, Savarino L, Cadossi M, Baldini N, Giannini S. Clin Orthop Relat Res. 2008 Mar;466(3):700-7. Epub 2008 Jan 9. Ceramic-on- ceramic coupling Youn-Soo Park, Sung-Kwan Hwang, Won-Sik Choy, Yong-Sik Kim, Young-Wan Moon, Seung-Jae Lim Ceramic Failure After Total Hip Arthroplasty with an Alumina-on-Alumina Bearing The Journal of Bone & Joint Surgery, Volume 88, Issue 4 Scientific Articles | April 01, 2006
S. J. MacDonald, Metal-on-Metal Total Hip Arthroplasty The Concerns CLINICAL ORTHOPAEDICS AND RELATED RESEARCH Number 429, pp. 86–93 © 2004 Lippincott Williams & Wilkins
|
Chirurgia Artroscopica e Protesica Mini Invasiva a cura del Dr. Gaetano Maci
+39 3408486387
gaetano.maci@gmail.com
Chirurgia protesica d’Anca
- Home
- Chirurgia mini-invasiva
- Chirurgia protesica d'Anca
Page Copyright
© Copyright 2018 All Rights Reserved
