MEDICINA RIGENERATIVA
Dott. Gaetano Maci
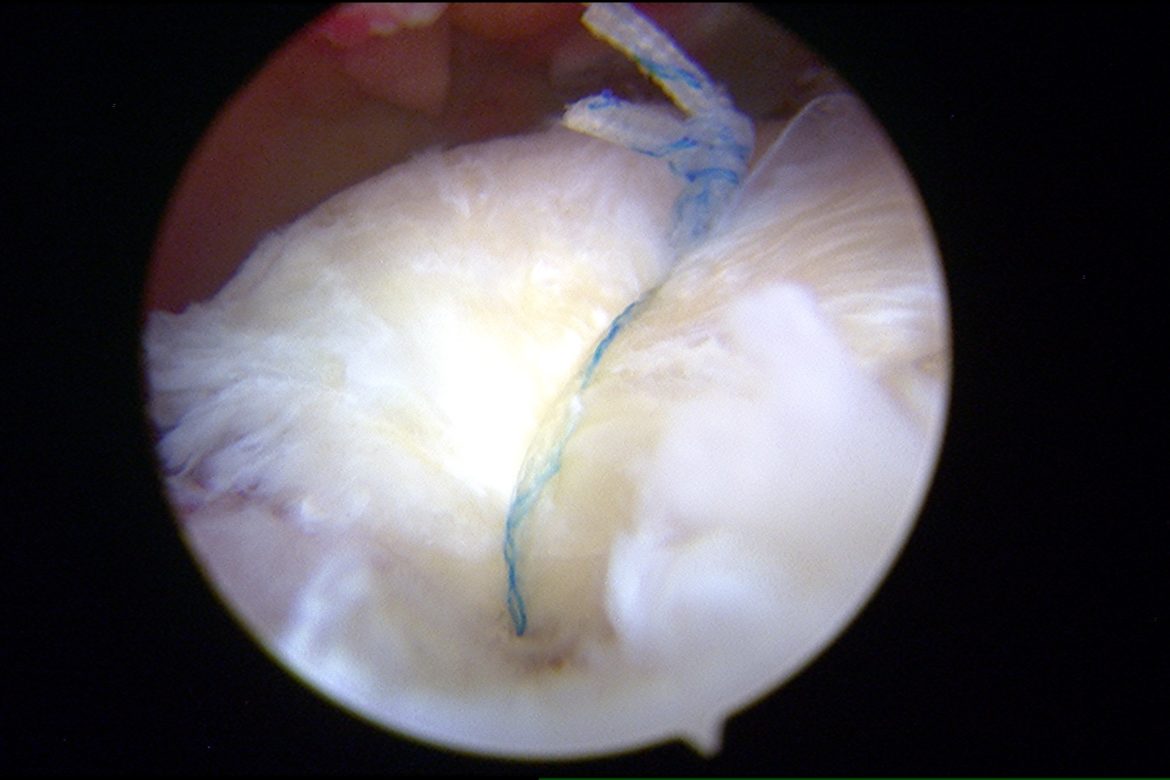
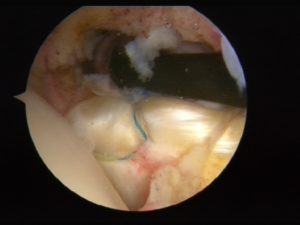
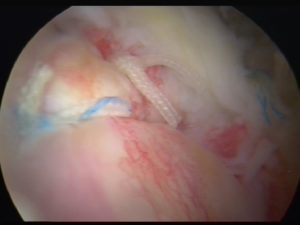
Con il termine “medicina rigenerativa” si intendono metodiche innovative e non invasive per trattare patologie degenerative dei tessuti connettivi; nel nostro caso: cartilagini, tendini, muscoli ed ossa.
La grande innovazione è quella di utilizzare le cellule del paziente stesso per curare le patologie ortopediche di cui è affetto.
Questo implica ovviamente nessun possibile rigetto, allergia o reazione indesiderata (come potrebbe avvenire con i farmaci) e nessun rischio chirurgico significativo (come potrebbe accadere con interventi di chirurgia maggiore).
LE METODICHE PIU’ INNOVATIVE UTILIZZATE OGGI AL MONDO SONO:
| PRP
(Plasma Ricco di Piastrine)
|
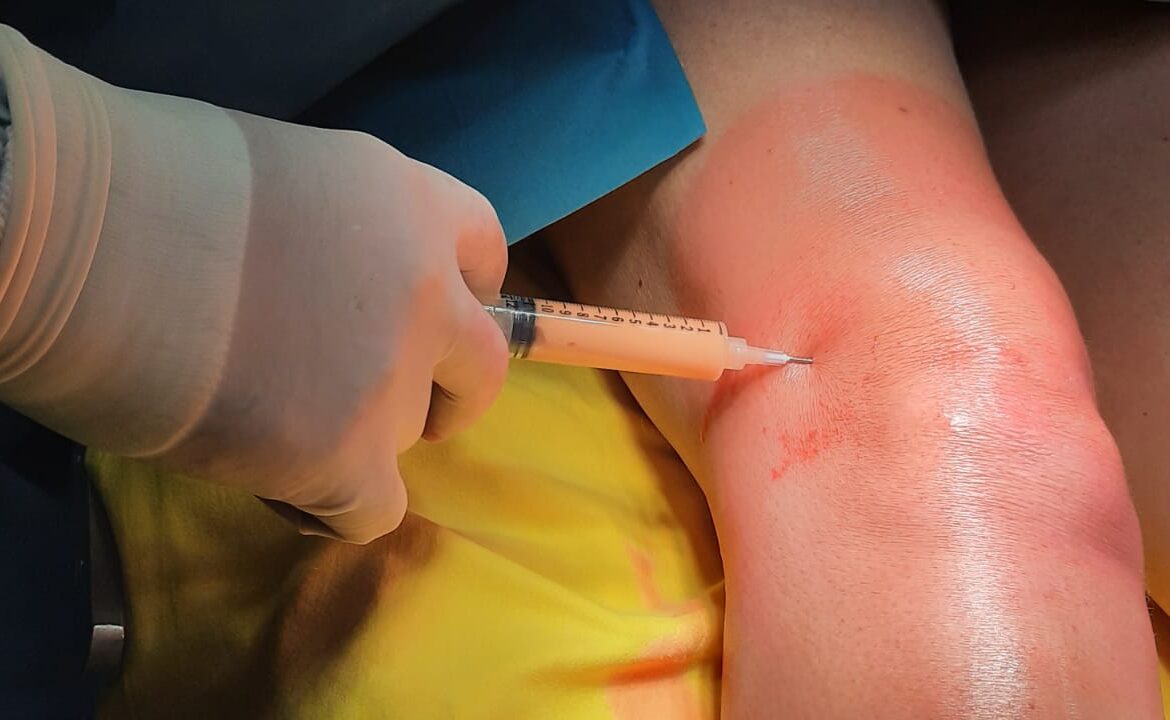
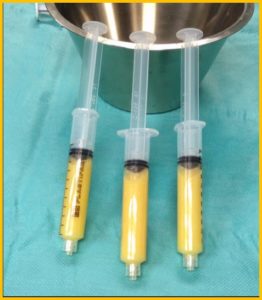
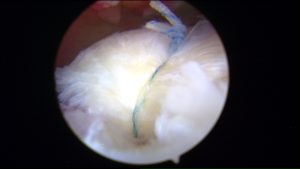
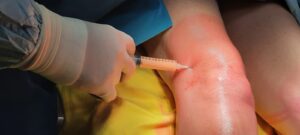
E’ ottenuto dalla centrifugazione del sangue venoso del paziente.
E quindi una procedura ambulatoriale ma sebbene la metodica sia molto semplice, deve essere eseguita in una struttura convenzionata con un centro trasfusionale. Lo utilizziamo soprattuto nelle tendinopatie dello sportivo ma ha indicazione anche per altri tessuti come cartilagine ed osso. Come funziona? Globuli rossi, globuli bianchi, plasma e piastrine sono i principali componenti del sangue. Le piastrine sono piccole cellule del sangue discoidi con granuli contenenti coaguli e fattori di crescita che vengono rilasciati durante il processo di guarigione ed hanno una durata media di 7-10 giorni. All’attivazione, le piastrine accelerano la cascata infiammatoria e guariscono con il rilascio dei granuli contenenti fattori di crescita. Rilasciano numerose sostanze che promuovono la riparazione tissutale e influenzano il comportamento di altre cellule modulando l’infiammazione e la neoformazione di vasi sanguigni. Giocano un ruolo fondamentale nel mediare la guarigione del tessuto danneggiato grazie alla capacità di liberare fattori di crescita, tra i quali il PDGF, il TGF β, il VEGF, l’IGF-1, l’FGF, e l’EGF. I granuli contenuti nelle piastrine sono anche una fonte di “citochine”, “chemochine” e molte altre proteine variamente coinvolte nello stimolare proliferazione e maturazione cellulare, nel modulare l’infiammazione e attivare altre cellule regolando l’omeostasi tissutale ed i processi rigenerativi.
|
| MSCs
(cellule staminali mesenchimali) da tessuto adiposo e da midollo osseo (bone marrow)
|
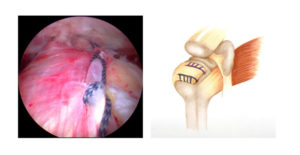
Cellule Staminali Mesenchimali sono cellule multipotenti e di particolare interesse in Ortopedia per il loro potenziale di differenziarsi in cellule che producono osso, cartilagine, tendini e legamenti.
Le MSCs posso essere isolate dal midollo osseo (bone marrow), pelle, sinovia, tessuto adiposo e molti altri tessuti di origine mesenchimale.
La terapia con MSCs in Ortopedia è attualmente indicata (vedi allegato in PDF: A Comprehensive Review of Stem-Cell Therapy) nelle seguenti patologie:
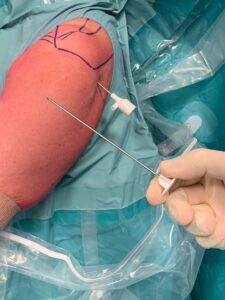
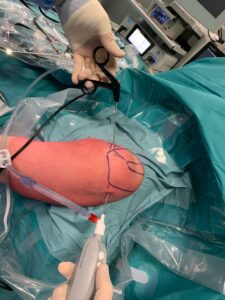
Le MSCs provenienti da midollo osseo (bone marrow) sono ottenute da una piccola cannula, grande poco più di un ago, inserita direttamente nella cresta iliaca (zona più ricca di cellule). Le ADSCs (Adipose Derived Stem Cells) provenienti da tessuto adiposo sono ottenute da una piccola liposuzione che si effettua in sala operatoria. Dal grasso ottenuto attraverso la liposuzione vengono isolate o per filtraggio oppure attraverso la centrifugazione, le cellule mesenchimali “multipotenti”.
In entrambi i casi, dopo la centrifugazione ed un solo step (senza più la necessità di una seconda procedura), si ottengono le cellule pronte ad essere infiltrate nell’area patologica.
La metodica attualmente più utilizzata è il prelievo da grasso addominale. Come funziona? Le cellule isolate dal grasso sono cellule staminali mesenchimali ovvero cellule multipotenti in grado di favorire la trasformazione nelle cellule del tessuto ospite (cartilagine, tendine, muscolo, osso). Tali cellule favoriscono doppiamente la rigenerazione, sia in maniera diretta che indiretta cioè attraverso l’azione paracrina (la loro peculiare capacità di “risvegliare” le cellule del tessuto ospite) stimolando la reazione anche nelle cellule locali. Sebbene gli studi clinici siano ancora in corso, la frazione stromale del tessuto adiposo sembra avere un vantaggio rispetto alle altre metodiche: in laboratorio appare meno soggetta all’invecchiamento cellulare e potrebbe quindi essere maggiormente efficace anche in soggetti meno giovani. In attesa di dati più solidi, resta la certezza che qualsiasi trattamento rigenerativo sia comunque più efficace nei pazienti giovani.
|
| MONOCITI
|
Sono ottenuti dalla filtrazione del sangue venoso del paziente.
E quindi una procedura ambulatoriale ma sebbene la metodica sia molto semplice, deve essere eseguita in una struttura convenzionata con un centro trasfusionale. Il sangue viene quindi filtrato con il fine di isolare i monociti. Il grosso vantaggio di questa tecnica molto innovativa è nella scarsissima invasività che non compromette però la potenza della rigenerazione. Pur essendo semplice come il PRP (è necessario un semplice prelievo venoso), ha una capacità rigenerativa indubbiamente maggiore che rende efficace solitamente, benché non sia una regola fissa, una sola infiltrazione, al contrario del PRP dove le infiltrazioni sono generalmente 3.
|
| TAKE HOME MESSAGE
|
· La Medicina Rigenerativa è una metodica rivoluzionaria perché utilizza le cellule del paziente (senza aggiunta di farmaci) per curare patologie croniche
· La terapia riduce il dolore e fornisce un sollievo duraturo da tendiniti croniche e artrosi
|